nivalecion segundo periodo AROMÁTICOS
HIDROCARBUROS AROMÁTICOS
OBJETIVOS
Tiene como objetivo identificar las principales características de los hidrocarburos aromáticos como diferenciar el concepto de aromático, no aromático y anti aromático, reconocer las condiciones para la aromaticidad y la regla de Huckel, familiarizarnos con la estructura química del Benceno, distinguir y caracterizar las propiedades físicas y químicas de los aromáticos, señalar correctamente la nomenclatura de los aromáticos, idéntica las reacciones de obtención o síntesis de los aromáticos y discutir los usos o aplicaciones de este grupo.
INTRODUCCIÓN
Este blogger tiene como finalidad a conocer con más profundidad todos los temas de los hidrocarburos aromáticos teniendo en cuenta su teoría sobre los aromáticos con algunos los ejemplos y ejercicios teniendo en cuenta el procedimiento de aprendizaje teórico y practico.
MARCO TEÓRICO
CONCEPTOS GENERALES
Que es : Un hidrocarburo aromático o areno es un compuesto orgánico cíclico conjugado que posee una mayor estabilidad debido a la deslocalización electrónica en enlaces π.2 Para determinar esta característica se aplica la regla de Hückel debe tener un total de 4n+2 electrones π en el anillo en consideración de la topología de superposición de orbitales de los estados de transición

PROPIEDADES FÍSICAS:
Los hidrocarburos aromáticos son compuestos insaturados de un tipo especial. Originalmente recibieron el nombre de aromáticos debido al aroma que algunos poseen. Sin embargo no todos son odoríferos y muchos compuestos fragantes no son de tipo aromático.Uno de los compuestos más simples y que se conoció primero con la estructura característica de los compuestos aromáticos fue el hidrocarburo benceno, por ello se dice que son hidrocarburos derivados del benceno.
Los compuestos aromáticos como todas las sustancias se encuentran en los estados siguientes: estado sólido y estado líquido.
La serie aromática se caracteriza por una gran estabilidad debido a las múltiples formas resonantes que presenta.Muestra muy baja reactividad a las reacciones de adición. Es un líquido menos denso que el agua y poco soluble en ella.Es muy soluble en otros hidrocarburos. Es soluble en éter, nafta y acetona. También se disuelve en alcohol y en la mayoría de los solventes orgánicos. Disuelve al yodo y las grasas.
PROPIEDADES QUÍMICAS:
• Se comporta como un compuesto de carácter saturado.
• No decolora el agua de bromo.
• No decolora el permanganato de potasio ( prueba de Bayer).
• Puede manifestar instauración.
• En casos especiales es posible que se lleven a cabo reacciones de adición.
• estos compuesto prevalece las reacciones de sustitución antes que las reacciones de adición.
• La mayoría de las reacciones proceden por el mecanismo de sustitución electrófilica.
FUENTES DE HIDROCARBUROS AROMÁTICOS
Los hidrocarburos aromáticos sencillos provienen de dos fuentes principales:
El carbón o Hulla: es una sustancia mineral constituida por anillos del tipo benceno unidos entre sí. Cuando se calienta a 1.000 °C, en la molécula de hulla ocurre desintegración térmica y destila una mezcla de hidrocarburos volátiles denominada alquitrán de hulla.
Cuando se destila esta mezcla se obtiene benceno, xileno, tolueno, naftaleno y una variedad de compuestos orgánicos.
El Petróleo consiste en una mezcla de alcanos y contiene pocos compuestos aromáticos. Sin embargo en la refinación del petróleo se forman compuestos aromáticos, cuando se hacen pasar los alcanos sobre un catalizador a 500°C, a altas presiones. El heptano (C7 H16) se transforma en tolueno (C7 H8) por deshidrogenación y ciclación.
EL BENCENO, PRINCIPAL REPRESENTANTE DE LOS AROMÁTICOS
El benceno es una molécula plana polinsaturada (es decir tiene más de un doble enlace entre sus carbonos), que presenta formas resonantes las cuales le confieren una gran estabilidad; de forma molecular C6H6, con forma de anillo. Es incoloro, de aroma dulce y sabor ligeramente amargo, similar al de la hiel. Se evapora al aire rápidamente y es poco soluble en agua. Es sumamente inflamable, volátil y se forma tanto en procesos naturales como en actividades humanas.

ESTRUCTURA QUÍMICA
En términos de la estructura de Lewis, se suele mostrar como un hexágono plano e indeformable en cuyos vértices se encuentran los átomos de carbono, con tres dobles enlaces y tres enlaces simples en posiciones alternas.
(1=2, 3=4, 5=6; 6-1, 2-3, 4-5; o bien 1=2-3=4-5=6-1)
La representación de los tres dobles enlaces se debe a Friedrich Kekulé, quien además fue el descubridor de la estructura anular de dicho compuesto y el primero que lo representó de esta manera.
Los dobles enlaces al estar alternados le otorgan a la molécula de benceno sus características tan especiales. Cada carbono presenta en el benceno hibridación Sp2. Estos híbridos se usarán tanto para formar los enlaces entre carbono como los enlaces entre los carbonos y los hidrógenos.
Espectroscópicamente, se ha determinado que:
Todos los enlaces C-C tienen la misma longitud (1,39 Armstrong) que es intermedia entre un enlace simple (1,54 Armstrong) y uno doble (1,34 Armstrong ).
Todos los ángulos de enlace C-C-C son de 120°
Esto último sugiere que todos los carbonos están hibridizados Sp2, luego la estructura básica del benceno considera un anillo plano de 6 átomos de carbono, en cada uno de ellos hay un orbital p. Como la distancia C-C es la misma y pequeña (1,39 Armstrong ), los orbitales p pueden superponerse efectivamente formando una nube electrónica homogénea.

ESTABILIDAD DEL BENCENO: CALORES DE HIDROGENACIÓN
Una de las peculiaridades del benceno (y de los compuestos aromáticos) es su gran estabilidad con respecto a la de los alquenos. Se puede obtener una medida cuantitativa de la estabilidad, determinando la cantidad de calor liberado cuando se hidrogenan el benceno y el ciclohexeno. En ambos casos se forma el mismo producto, el ciclohexano.
Si los tres dobles enlaces del benceno fueran equivalentes a tres dobles enlaces etilénicos (-C=C-), el calor liberado por hidrogenación completa en presencia de un catalizador, sería tres veces mayor que el liberado por hidrogenación del ciclohexeno.
La diferencia entre los calores de hidrogenación de un mol de benceno y tres moles de ciclohexeno, es la energía de deslocalización de electrones (energía de resonancia).
85,8-49,8= 36 Kcal/mol menos que la esperada si sus tres dobles enlaces fueran semejantes a los de los alquenos, indica que el benceno contiene 36 Kcal/mol menos que el esperado teóricamente. El benceno es un sistema conjugado cíclico estabilizado por deslocalización de electrones.


AROMATICIDAD
En los inicios de la química orgánica, la palabra aromático se usaba para describir sustancias fragantes como el benzaldehído (de cerezas, durazno y almendras), el tolueno (del bálsamo de tolú) y el benceno (del destilado del carbono); por lo que se asocio la aromaticidad con los compuestos que contenían el anillo benceno. Sin embargo, pronto se comprendió que las sustancias agrupadas como aromáticas se comportaban de manera químicamente distinta de cómo lo hacen la mayoría de los otros compuestos orgánicos, por lo que la teoría moderna ha extendido el concepto de aromaticidad para incluir a sistemas policíclicos como el naftaleno, antraceno, fenantreno e incluso a ciertos cationes y aniones que poseen el número adecuado de electrones pi y que son capaces de crear formas resonantes.
DIFERENCIA ENTRE AROMÁTICO, NO AROMÁTICO Y ANTIAROMÁTICO
AROMATICO: si el anillo tiene una menor energía de electrones pi que la cadena abierta.
NO AROMATICO: si el anillo y la cadena tienen la misma energía de electrones pi.
ANTIAROMATICO: si el anillo tiene una energía de electrones pi superior a la de la cadena abierta.
REGLA DE HÜCKEL
Según el científico Alemán Erich Hückel, una molécula será aromática si tiene un sistema monociclo planar, con un orbital P en cada átomo y solo si el sistema de orbitales P contiene 4n + 2 electrones Pi donde n es un numero entero (0, 1, 2, 3,4...), es decir las moléculas que contienen 6(n=1),10(n=2),14(n=3),18(n=4)…Electrones Pi pueden ser aromáticas. Las moléculas que contienen 4n electrones Pi (4, 8, 12,16...) no pueden ser aromáticas aunque sean cíclicas y conjugadas, debido a que algunos ciclos a pesar de cumplir con la regla de Hückel son planos y los H impiden la coplanaridad del anillo, por lo tanto los orbitales p no se superponen con eficiencia y la molécula aumenta su energía.
CONDICIONES PARA LA AROMATICIDAD
Para que un compuesto sea aromático, y por tanto posea una elevada estabilidad termodinámica y una reactividad química diferente de la de los alquenos y polienos conjugados, debe cumplir las siguientes condiciones:
- Su estructura debe ser cíclica y debe contener enlaces dobles conjugados.
- Cada átomo de carbono del anillo debe presentar hibridación Sp2, u ocasionalmente Sp, con al menos un orbital p no hibridizado.
- Los orbitales p deben solaparse para formar un anillo continuo de orbitales paralelos. La estructura debe ser plana o casi plana para que el solapamiento de los orbitales p sea efectivo.
- Además debe cumplir la regla de Hückel.

NOMENCLATURA
Los compuestos aromáticos se nombran sistemáticamente por las reglas de la IUPAC (Unión Internacional de química pura y aplicada), pero también se utilizan varios nombres comunes
ESTOS SON:
Triviales
 |
| ANILINA |
 |
| FENOL |
 |
| TOLUENO |
 |
| ÁCIDO BENZOICO |
 |
| BENZALDEHIDO |
 |
| NITROBENZENO |
 |
| ESTIRENO |
 |
| PARA-XILENO |
 |
| ÁCIDO GÁLICO |
SISTEMÁTICAS
 |
| METIL BENCENO |
 |
| ETIL BENCENO |
 |
| BROMO BENCENO |
SUSTITUYENTE
BENCENICOS DISUSTITUIDOS
O-dimetilbenceno m-dimetilbenceno p-dimetilbenceno
1,2-dimetilbenceno 1,3-dimetilbenceno 1,4-dimetilbenceno
No 2-metiltolueno no 3-metiltolueno no 4 metilbenceno
No 2-metiltolueno no 3-metiltolueno no 4 metilbenceno
Ni o-metiltolueno o m-metiltolueno o p-metiltolueno
SUSTITUYENTES
2-bromo-1-metil-4-nitrobenceno 2, 4,6-tribromofenol
O 2-bromo-4-nitrotolueno
O 2-bromo-4-nitrotolueno
EJERCICIOS



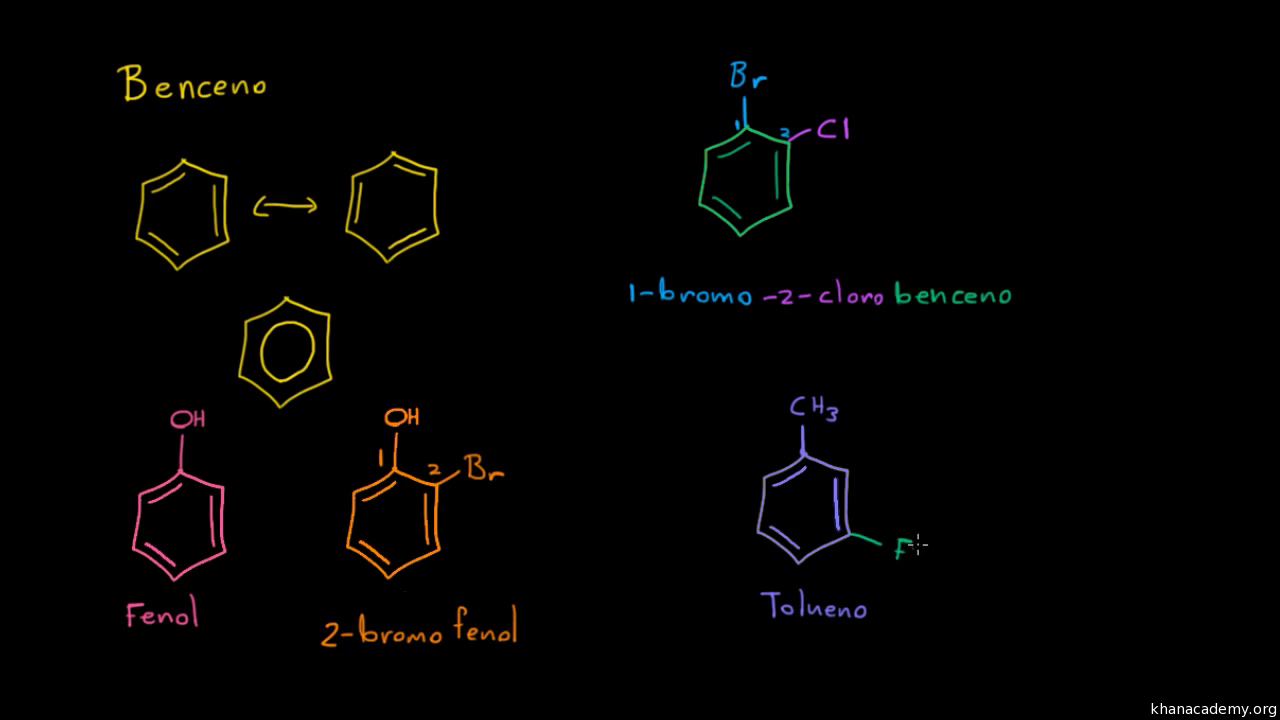

WEB GRAFIA
https://www.alonsoformula.com/organica/aromaticos.htm
https://es.wikibooks.org/wiki/Qu%C3%ADmica/Hidrocarburos_arom%C3%A1ticos
https://quimica.laguia2000.com/quimica-organica/hidrocarburos-aromaticos
https://es.wikipedia.org/wiki/Hidrocarburo_arom%C3%A1tico
http://www.100ciaquimica.net/





WEB GRAFIA
https://www.alonsoformula.com/organica/aromaticos.htm
https://es.wikibooks.org/wiki/Qu%C3%ADmica/Hidrocarburos_arom%C3%A1ticos
https://quimica.laguia2000.com/quimica-organica/hidrocarburos-aromaticos
https://es.wikipedia.org/wiki/Hidrocarburo_arom%C3%A1tico
ACTIVIDAD AROMÁTICOS
1.
EJERCICIOS DE FORMULACIÓN





































FALTARON EJERCICIOS 4,0
ResponderEliminarNIVELACION 4.0
ResponderEliminar