NOMENCLATURA DE ALCOHOLES Y FENOLES
NOMENCLATURA DE ALCOHOLES Y FENOLES
INTRODUCCIÓN:
Los alcoholes de denominan compuestos de fórmula general R (OH), esto quiere decir que son compuestos que contienen uno o más grupos de hidroxilos unidos a un mismo radical alquilo.
Cuando el número de grupos OH es más de uno, se conocen generalmente como alcoholes polihidroxílicos o polioles, recibiendo denominaciones particulares para cada número de grupos. El radical puede ser saturado o instaurado y de cadena abierta o cíclica.
También puede ser un radical aromático, caso en el cual los alcoholes toman el nombre genérico de fenoles. Tanto fenoles como alcoholes contienen el grupo funcional -OH (hidroxilo), que determina las propiedades características de la familia. Sin embargo los fenoles, aunque dan algunas reacciones análogas a las de los alcoholes, se diferencian de muchas otras.
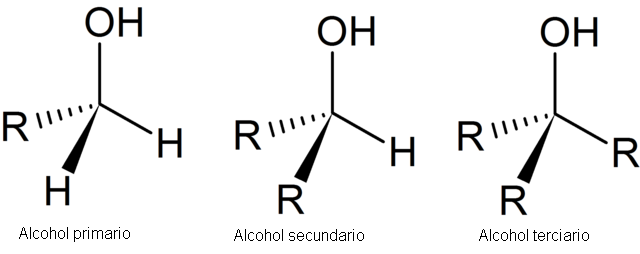
Los alcoholes se designan en forma general como R-OH y los fenoles como Ar-OH en donde R y Ar representan un grupo alquil o el cicloalquil y un anillo aromático, respectivamente. Los alcoholes se pueden clasificar según su estructura como primarios, secundarios o terciarios, este dependiendo el número de radicales unidos a un solo átomo de carbono que contiene el grupo -OH como lo dicho anteriormente.

OBJETIVOS:
Este blog tiene como objetivo la identificación del grupo funcional hidroxilo, sus propiedades físicas (pH) del grupo funcional hidroxilo, aprender a diferenciar por reacciones químicas, alcoholes de fenoles. y por ultimo identificar los tipos de alcoholes.
Marco Teórico:
Los alcoholes son líquidos o sólidos neutros. El grupo hidroxilo confiere características polares al alcohol y según la proporción entre él y la cadena hidrocarbonada así será su solubilidad. Los alcoholes inferiores son muy solubles en agua, pero ésta solubilidad disminuye al aumentar el tamaño del grupo alquilo y aumenta en los solventes orgánicos.Las diferentes formas geométricas de los alcoholes isómeros influyen en las diferencias de solubilidad en agua. Las moléculas muy compactas del alcohol ter-butílico experimentan atracciones intermoleculares débiles y las moléculas de agua las rodean con más facilidad. Consecuentemente, el alcohol ter-butílico exhibe la mayor solubilidad en agua de todos sus Isómeros.Los fenoles son un grupo de compuestos orgánicos que presentan en su estructura un grupo funcional hidroxilo unido a un radical arilo. Por lo tanto, la fórmula general para un fenol se escribe como Ar – OH. Los fenoles sencillos son líquidos o sólidos, de olor característico, poco hidrosolubles y muy solubles en solventes orgánicos. Algunos se usan como desinfectantes, pero son tóxicos e irritantes. Los fenoles son más ácidos que el agua y los alcoholes, debido a la estabilidad por resonancia del ión fenóxido. El efecto de esta resonancia consiste en la distribución de la carga del anión sobre toda la molécula en lugar de estar concentrada sobre un átomo particular, como ocurre en el caso de los aniones alcóxido.
ALCOHOLES

Los alcoholes son compuestos de fórmula general ROH, en donde R es cualquier grupo alquilo,incluso sustituido. El grupo puede ser de cadena abierta o cíclico" puede contener un doble enlace,un atomo de halógeno, un anillo aromatico, o grupos hidroxilo adicionales. Se puede pensar en los alcoholes como derivados del agua donde uno de sus hidrógenos ha sido reemplazado por grupos hidrocarbonados. Los alcoholes se clasifican como primarios, secundarios y terciarios, de acuerdo con el tipo de carbono que tiene el grupo funcional hidroxilo. Las variadas posiciones que puede adoptar el grupo funcional ) pueden afectar la velocidad de ciertas reacciones y el tipo de reacción.
propiedades físicas
Los alcoholes a temperatura ambiente son líquidos incoloros e inodoros de peso molecular y de olor característico, su densidad es menor a la del agua.
Las propiedades físicas de un alcohol se comprenden mejor, si reconocemos este hecho simple estructural mente, el alcohol es un derivado de un alcano y agua. Contiene un grupo lipófilo, del tipode un alcano, y un grupo hidróxilo que es hidrófilo, similar al agua. De estas dos unidadesestructurales, el grupo ) da a los alcoholes sus propiedades físicas características y el alquiloes el que las modifica, lo que depende de su tamaño y forma. El grupo es muy polar y, lo importante, es capaz de establecer puentes de hidrógeno con sus moleculas compañeras, con otras moleculas neutras y con aniones entre los hidrocarburos, los factores que determinan puntos de ebullición suelen ser principalmente el peso molecular y la forma, lo que es de esperar de moleculas que se mantienen unidas esencialmente por fuerzas.
Comparando los hidrocarburos y los alcoholes de peso molecular semejante, se observa una gran diferencia en el valor de sus puntos de ebullición. Lo anterior se explica teniendo en cuenta que para convertir un líquido en gas, es necesario vencer las fuerzas de atracción entre las moleculas del líquido estas atracciones intermoleculares son debiles en los alcanos ya que sus moleculas son no polares. En cambio, el enlace oxígenohidrógeno de los alcoholes es bastante polar y, en consecuencia, existen atracciones dipolares entre moleculas, específicamente entre el hidrógeno de una molecula y el oxígeno y sus electrones no enlacantes.
una estrecha asociación intermolecular llamada puentes de hidrógeno, lo que proporcionaatracciones maximas, dando como resultado mayores puntos de ebullición.El comportamiento de los alcoholes en cuanto a su solubilidad tambien refleja la tendencia a formar puentes de hidrógeno. En marcado contraste con los hidrocarburos, los alcoholes inferiores son miscibles con agua. puesto que las moleculas de los alcoholes se mantienen unidas por el mismo tipo de fuerzas intermoleculares que las de agua, puede haber mezcla de las dos clases de moleculas y la energía necesaria para romper un puente de hidrógeno entre dos moleculas de agua o dos de alcohol, es proporcionada por la formación de un puente entre una molecula de agua y otra de alcohol. Sin embargo, esto es cierto sólo para los alcoholes inferiores, en los que el grupo constituye una parte considerable de la molecula. A medida que el grupo lipófilo aumenta de tamaño,disminuye la solubilidad en agua.
Ph de los alcoholes
los alcoholes son bases, y de una fuerza similar a la del agua.Como el agua, también contiene oxígeno, y este oxígeno, con sus pares no compartidos, los hace básicos. Hemos visto muchas veces que su basicidad tiene un papel central en la determinación de su comportamiento químico, como sustratos y como reactivos. aceptan protones de acidos para generar alcoholes protonados, protonación que les permite actuar como sustratos en la sustitución nucleofílica y en la eliminación algo que no pueden hacer en la forma no protonada. Aceptan protones de carbocationes, con lo que actúan como reactivos basicos para provocar una eliminación. Su basicidad tambien los hace nucleofílicos y capaces de causar sustitución en reacciones netas, prestando ayuda nucleofílica a la formación de carbocationes o combinandose con carbocationes, una vez que estos se han formado. Tambien hemos dicho que los alcoholes son acidos, y de fuerza similar al agua. El hidrógeno esta ligado al muy electronegativo elemento oxígeno. La polaridad del enlace facilita la separación de un protón relativamente positivo desde otro punto de vista, el oxígeno electronegativo acomoda muy bien la carga negativa de los electrones abandonados.La acidez de los alcoholes se demuestra por su reacción con metales activos para liberar hidrógeno gaseoso y formar alcóxidos.


FENOLES

Los fenoles son compuestos de fórmula general AROH , donde AR es fenilo, fenilo sustituido, o alguno de los demas grupos arilo. Los fenoles difieren de los alcoholes por tener el grupo - OH directamente unido al anillo aromatico. Los fenoles y los alcoholes contienen el grupo -OH , por lo que ambas familias hasta cierto punto se asemejan. por ejemplo, tanto fenoles como alcoholes pueden convertirse en eteres y esteres. Sin embargo, en la mayoría de sus propiedades, como en su preparación, ambos compuestos difieren amplia mente, por lo que merecen ser clasificados como familias diferentes.
propiedades físicas
Los fenoles mas sencillos son líquidos o sólidos de bajo punto de fusión tienen puntos de ebullición bastante elevados, debido al hecho de que forman puentes de hidrógeno. El fenol mismo tiene cierta solubilidad en agua 9g por 100g de agua(, probablemente por la formación de puentes de hidrógeno con ella. La mayoría de los otros fenoles es, esencialmente, insoluble. El fenol es poco soluble en agua ya que aunque presenta un puente de hidrógeno, la proporción de - OH respecto a la cantidad de carbonos es muy baja. para que los compuestos que contienen grupos -OH sean solubles en agua, la razón entre carbonos y grupos -OH no debe ser mayor de 3.1. El fenol, el miembro mas pequeño de este grupo contiene : 6 tomos de carbono y un solo grupo -OH .Los demas monofenoles poseen mayor numero de carbonos y un solo grupo -OH, por ello son insolubles en agua. Los difenoles y polifenoles con mas de un grupo -OH presentan mayor solubilidad en el agua. Son en sí incoloros, salvo que presenten algun grupo capaz de imponerles coloración. Si nembargo, y al igual que las aminas aromaticas, se oxidan con facilidad, por lo que a menudo se les encuentra coloreados, a menos que esten cuidadosamente purificados, por la presencia de productos de oxidación.
Ph de los fenoles
La propiedad característica que distingue a los fenoles de los alcoholes es la acides. Los fenoles son débilmente acidos y se pueden neutrali%ar con hidróxido de sodio. Los alcoholes son de un millón a mil millones de veces menos acidos que el fenol y no se neutralizan con hidróxido de sodio.
Propiedades físicas
Aparte de su acidez, la propiedad química mas notable de un fenol es la reactividad extremadamente elevada de su anillo en la sustitución electrofílica. La acidez desempeña un papel importante incluso en la sustitución anular, ya que la ionización de un fenol genera el grupo -O aun mas liberador de electrones que el -OH, debido a su carga negativa.Los fenoles no sólo dan las reacciones de sustitución electrofílica típicas en la mayoría de los compuestos aromáticos, sino también muchas otras, que son posibles gracias a la reactividad excepcional del anillo.
Nomenclatura de alcoholes y fenoles
Las reglas de la IUPAC para nombrar los alcoholes son:
1. Seleccione la cadena más larga que contenga el grupo hidroxilo. Cambie la "o" final del nombre del hidrocarburo correspondiente a esta cadena por el sufijo ol.
2. Numere la cadena en tal sentido que al grupo funcional le corresponda el número más bajo posible. Si existen dos, tres o más grupos OH, utilice los prefijos di, tri, etc.
3. Indique las posiciones de grupos sustituyentes por el correspondiente localizador en la cadena.
Veamos algunos ejemplos de aplicación de estas tres reglas:
Nótese que algunos compuestos no son fenoles, a pesar de la presencia del benceno como grupo fenílico. Para que fueran fenoles, el grupo OH debería estar directamnete unido a uno de los carbonos del anillo aromático.
4. Si, además del grupo OH, el compuesto presenta enlaces dobles o triples, sigue premiando la condición de alcohol, por lo que a dicho grupo le corresponde el localizador más bajo. Los enlaces dobles y triples se identifican por los respectivos sufijos.
Por ejemplo:





Conviene agregar que los alcoholes insaturados reciben los nombres genéricos de los alquenoles y alquinoles, según presentan enlaces dobles o triples. Los saturados son los alcanoles.
Nombres comunes
Para los alcoholes más sencillos se emplean frecuentemente nombres comunes o triviales, que consisten simplemente de la palabra alcohol y el nombre del grupo alquílico (o arílico) con el sufijo ico. Los más usuales son:

Los alcoholes que contienen dos grupos hidroxílicos se conocen comúnmente como glicoles. Por ejemplo:

Nomenclatura de fenoles
Los fenoles son comúnmente nombrados como derivados de los compuestos más simples de la familia. Así:


BIBLIOGRAFIA
EJERCICIOS


FALTO IMAGEN 4,0
ResponderEliminar